千乘镜像 | 另类“脑洞大开”——活体颅骨光学透明技术
时间:2023-03-03 16:56 来源:中国医药卫生网 作者:doudou 点击:次
前 言 小鼠大脑在自然环境中的无创成像对于研究神经网络功能和疾病进展至关重要。但在活体状态下,大脑有颅骨覆盖,而颅骨对光的强散射和像差严重限制了光的穿透深度,进而影响了皮层成像的分辨率和深度。以往的解决办法是进行各类手术构建颅窗,主要包括磨薄颅骨窗、开颅玻璃窗等。磨薄颅骨窗是将部分颅骨磨薄至约25 μm左右,虽然这样颅骨不会过多地限制光的穿透,可以实现对皮层的活体高分辨观测。但磨薄颅骨窗不适用于大视场观测皮层,因为将大面积的颅骨均匀地磨薄至25 μm非常困难。另外,颅骨被磨薄后会重新生长,并且新生的颅骨质地会发生变化、易碎,成像质量会随着反复磨薄越来越差、且难以实现多次的重复打磨。所以,磨薄颅骨窗不适用于长期跟踪观测。而开颅手术容易导致炎症反应,且大多会有较长的术后期,不适合对急性模型的观测。此外,侵入性的颅骨开窗手术还可导致多种生理反应,如小胶质细胞激活、颅压和脑脊液损失等,会对实验数据产生负面影响。 相比之下,非侵入性的颅骨透明技术可通过完整的颅骨成像为活体状态下的大脑监测提供了另一种方法。研究人员曾使用生物相容性试剂使颅骨本身透明,目的是为光学成像提供一个大窗口,而无需开颅手术或磨薄颅骨。然而,过去开发的技术不能提供长期观察的稳定窗口或高度透明的颅骨。近年兴起的组织光透明技术可以降低生物组织的散射,增强光在组织中的穿透能力,已被广泛应用于离体大组织甚至全器官三维高分辨成像。不仅如此,组织光透明技术在活体水平也得到了很好的应用,可以在不进行开颅手术的情况下,结合多种现代光学成像手段,实现大脑皮层的神经血管结构和功能的观测。光透明颅窗这种另类“脑洞大开”的技术可以避免手术带来的炎症反应,从而适用于急性观测。也可以通过反复操作观测数月,从而实现长期跟踪监测。本文对几种活体颅骨光透明技术进行简要的介绍。
TIS(光透明颅骨窗)应用于小鼠脑结构和功能的成像。通过完整颅骨窗口,可以在数周内保持大面积的小鼠颅骨透明,以便进行高分辨率光学成像。
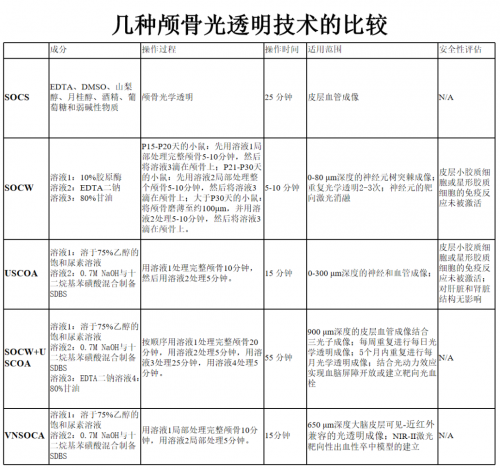
常用的活体颅骨光透明技术 和皮肤等软组织不同,颅骨的主要成分包括羟基磷灰石(钙质)、胶原蛋白(16%)、脂质(54%)和水(14%)。因此,活体颅骨光透明的基本原理就是部分去除颅骨中的钙质、脂质和蛋白质,并用折射率匹配液进一步提高透明效果。目前主要的活体颅骨光透明技术有以下几种:
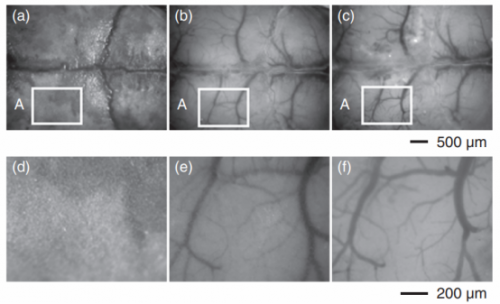
为了去除颅骨中的散射子,研究人员发明了一种颅骨光透明液(Skull Optical Clearing Solution,SOCS),它是一种包含EDTA,DMSO、山梨醇、月桂醇、乙醇、葡萄糖的弱碱性溶液。在实验过程中,首先将小鼠的头皮剪开,暴露颅骨,然后将颅骨用SOCS 孵育25 min ,即可让混浊的颅骨变得透明,皮层微血管也逐渐从不可见变得清晰可见。这种方法能够分辨的最小血管直径为(14.4±0.8)μm,而在开颅状态下可分辨的最小血管直径为(12.8±0.9)μm,证明颅骨透明化的成像效果接近于开颅状态。SOCS 可以提高激光散斑成像的质量,实现皮层血流分布可视化。
从完整头骨(a)获得的典型白光图像,SOCS处理25分钟后透明颅骨,不暴露(b)和暴露出矩形区域A(c)的皮层。(d) 、(e)和(f)是(a)、(b)和(c)矩形区域A的相应放大图。
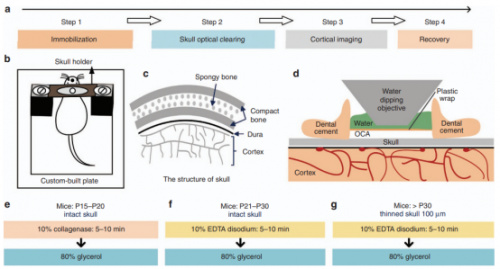
研究人员开发出一种优化的颅骨光透明窗(Skull Optical Clearing Window,SOCW),结合双光子荧光显微镜可以获得达到突触级别的成像分辨率。颅骨中的无机基质和有机基质的主要成分分别是羟基磷灰石钙和胶原蛋白,随着小鼠年龄的增长,无机基质和有机基质的比例也会发生变化。因此,针对不同周龄的小鼠,研究人员开发了不同的颅骨清除方法以建立光透明窗。SOCW 的建立步骤分为两步:首先,对于出生15~20天的小鼠,用10%的胶原酶溶液局部孵育完整颅骨5~10 min;对于出生21~30天的小鼠,将胶原酶溶液置换为10%的EDTA 二钠溶液,同样孵育5~10 min;对于出生超过30天的小鼠,颅骨生长得更厚,因此需要先将颅骨磨薄至约100 μm,然后用10%的EDTA 二钠溶液孵育5~10 min。进一步,将80%的甘油滴加在颅骨上,进行折射率匹配,即完成了光透明颅窗的建立。利用双光子荧光显微镜,可以透过SOCW 实现对皮层20~80 μm 深处的神经元树突棘的观测。但是,该方法用于4 周龄以上的小鼠时需要对颅骨进行打磨,不仅增加了实验难度,还会遇到与磨薄颅骨窗同样的问题,即难以实现大视场的观测以及长期重复观测。
SOCW皮层成像技术示意图
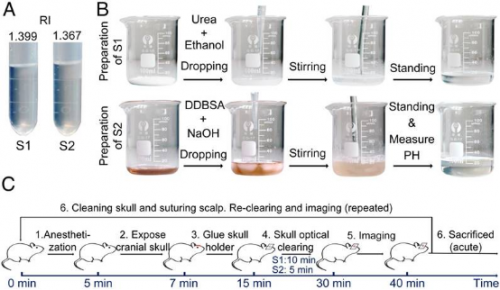
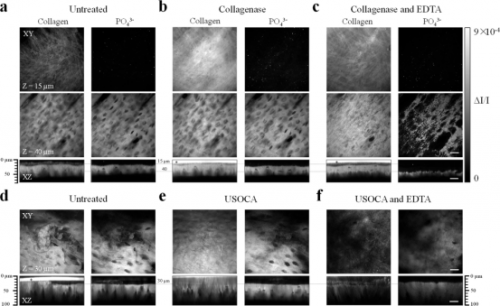
2018年,研究人员开发了一种基于尿素的光透明方法(Urea-based Skull Optical Clearing Agent,USOCA),成功解决SOCW 未能解决的两大难题,即视场较小和无法实现长期跟踪。USOCA 包含两种混和试剂,第一种S1是75% 乙醇溶解的饱和尿素溶液,乙醇溶液与尿素的体积-质量比约为10∶3 mL/g。乙醇分子上的羟基可以促使胶原解离,而尿素不仅因其有水合作用而被广泛用于组织透明化,还可以起到促渗的作用。另一种S2是高浓度的十二烷基苯磺酸钠(Sodium Dodecyl Benzene Sulfonate,SDBS)溶液,它是由0.7 mol/L的氢氧化钠溶液与十二烷基苯磺酸配置而成的,前者与后者的体积-质量比约为24∶5 mL/g,且pH 值保持在7.2~8 的范围内。十二烷基苯磺酸钠是一种离子型去垢剂,有去脂作用,可以使得颅骨成分更加均一。剪开小鼠头皮、暴露颅骨后,将第一种试剂S1滴加在颅骨,其间用镊子夹住小棉球不断在颅骨上擦拭以进行物理促渗,颅骨会慢慢变透明。10 min后擦除S1,将第二种试剂S2滴加在颅骨上,并孵育5 min,在这段时间内,颅骨会很快变得更为透明。由于完全不需要对颅骨进行磨薄处理,可以根据实验需要调整光透明颅窗的尺寸。实验人员利用USOCA 对缺血性脑卒中及再灌注过程进行了双侧大脑皮层的血流成像。待成像完成后,用磷酸盐缓冲液(Phosphate Buffer Solution,PBS)将光透明试剂清洗干净,颅骨即可恢复至原有状态,即“关闭”光透明颅窗。若需要进行重复成像,只需再进行透明操作即可再次“打开”光透明颅窗。USOCA 可以适用于2~8 月龄的小鼠,这一特性与大视场和可长期重复“开合”的特性,极大地拓展了活体颅骨光透明技术的应用范围。但是,USOCA 结合双光子荧光显微术,也仅能获得皮层300 μm 的成像深度,这远远不到小鼠皮层的厚度(>1 mm)。因此光透明颅窗的透明度还有待进一步提升,来满足深皮层成像的需求。
USOCA的制备和实验程序。(A) USOCA照片。(B) S1和S2的制备步骤。(C)实验步骤。
为了进一步提高光透明颅窗的透明度,研究人员将SOCW 和USOCA 两种颅骨光透明方法进行结合。他们利用非标记的高光谱受激拉曼散射(Stimulated Raman Scattering,SRS)显微术对两种颅骨光透明方法的分子机制进行了阐释。SRS 可以将光透明剂对颅骨不同成分的影响进行可视化。SOCW 的主要成分是胶原酶和EDTA。10% 的胶原酶孵育5~10 min 后,颅骨表面的胶原纤维能得到有效解聚。但胶原酶不能降解羟基磷灰石和羟基磷灰石内部的胶原。相反,EDTA 孵育5~10 min后,骨陷窝周围形成大量空腔,颅骨内羟基磷灰石的厚度明显降低。这意味着EDTA不仅能分解羟基磷灰石,还能使蛋白质均质化。USOCA的主要有效成分是尿素的75%乙醇溶液和十二烷基苯磺酸钠溶液。USOCA 孵育15 min 后,颅骨表面和深层区域的蛋白均被解聚并重新均匀分布。与胶原酶相比,USOCA 具有更强的溶解蛋白质的能力。科研人员依次用USOCA(25 min)、10% 的EDTA(25 min)对颅骨进行孵育,去除后滴加80% 的甘油并进行成像,可以得到非常显著的透明效果。结合三光子荧光显微镜,可以对皮层850 μm 深的血管进行成像观测。将SOCW 和USOCA 进行结合,进一步拓展了光透明颅窗下的成像深度。但是,结合两种方法,使得光透明颅窗的建立时间接近一个小时,降低了便捷性。另一方面,同时去除了颅骨中的胶原蛋白和羟基磷灰石,可能使得颅骨的刚性结构、以及它对大脑的保护作用受到影响,不利于长期跟踪观测。
颅骨光学透明过程的3D 拉曼散射图像。(a-c)18日龄小鼠顶骨中胶原纤维和羟基磷灰石的显微结构图像。颅骨未经处理(a),用10%胶原酶处理5-10分钟(b),然后用10%EDTA处理5-30分钟(c)。(d-f)2月龄小鼠顶骨中胶原纤维和羟基磷灰石的微观结构变化。治疗前的骨骼(d),USOCA治疗15分钟(e),然后在另一块骨骼上使用10%EDTA治疗5-10分钟(f)。头盖骨来自头骨的顶骨区域,在图f中用黑色方框表示。标尺,30 μm。
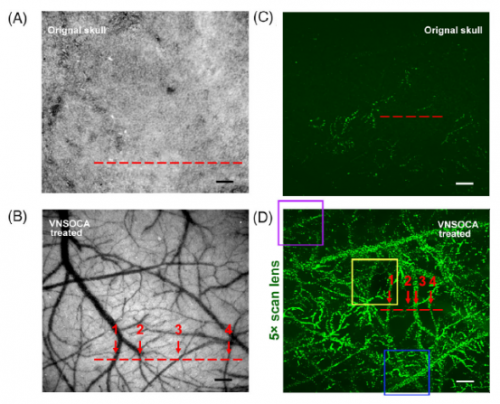
颅骨光透明技术主要着眼于减低颅骨的散射,这对于利用可见光和近红外Ⅰ区(700~900 nm)波段的成像非常重要。但是,在近红外Ⅱ区(900/1000~1700 nm),生物组织的散射减少,吸收就是另一个需要考虑的重要因素。研究人员测量了USOCA 方法所用的两种混和试剂的透过率,发现在近红外Ⅱ区、尤其在1300 nm以上的波段有着非常大的吸收,这对于近红外Ⅱ区成像显然非常不利。该吸收主要是光透明试剂中的重要成分水(H2O)带来的。为了克服这一问题,研究人员将水替换成在可见光到近红外Ⅱ区均有较高透过率的重水(D2O),并将以此配置的颅骨光透明试剂命名为适用于可见-近红外Ⅱ区的颅骨光透明试剂(Visible-Near infrared Ⅱ-compatible Skull Optical Clearing Agent,VNSOCA)。研究人员首先用体外成像实验比较了USOCA 和VNSOCA 对近红外二区激发的非线性光学成像的适用性,将一种三倍频探针的溶液放置在毛细玻璃管中,将其放置在1560 nm飞秒激光激发的三倍频显微镜下,分别将USOCA 和VNSOCA 作为成像介质进行成像。结果表明,由于USOCA 对激发光有较大的吸收,限制了整套成像方案的效率,因而探测到的三倍频信号非常有限。相对的,VNSOCA 作为成像介质时,测得的信号强度提升了3 倍以上。后续活体实验结果表明,即使基于利用近红外二区(1560 nm)激发的三倍频成像技术,也只能在浑浊颅骨下获取皮层200 μm 深的毛细血管结构,而VNSOCA 建立的光透明颅窗,可以将穿颅血管成像深度提升3 倍以上。VNSCOA 的发明,为颅骨光透明技术在近红外Ⅱ区成像领域的应用提供了方法,拓展了光透明颅窗适用的波段范围。
A和B,光学透明剂(VNSOCA)处理前后的颅骨皮层血管可见-近红外兼容的光透明的典型白场图像。C和D,在颅骨透明前后用×5扫描透镜采集的典型大视场三倍频(THG)成像。
展 望 活体颅骨光透明技术已经应用于多个领域,如神经血管成像、皮层光操控、建立特定的疾病模型等,为活体皮层观测提供了一个无需开颅的光学窗口。不同的脑科学研究对颅窗的要求不同。比如,神经突触成像需要高分辨观测,许多疾病的研究需要长时程跟踪,急性病理模型需要建窗口立即观测,神经功能成像需要在清醒动物上开展,跨脑区研究需要较大的观测视场。而光透明颅窗发展至今,已同时具备了高分辨、大视场、长时程、适用于急性观测的优势,因而有望在某些传统颅窗无法胜任的场合(比如急性创伤性脑损伤的跨脑区观测)提供重要的技术支撑,从而在未来的脑科学研究中大放异彩。但是,仍旧要意识到目前颅骨光透明技术依然有所限制。比如,目前尚未有适用于更大动物(比如大鼠、猕猴等)的活体颅骨光透明方法,这需要研究人员继续探索更高效的颅骨光透明方法。未来更好的颅骨光透明的出现,结合更多的成像方法,会为脑科学的发展提供更有力的技术保障。
参考文献: 1.Xu C. Optical clearing of the mouse skull[J]. Light: Science & Applications, 2022, 11(1): 1-2. 2.Li D, Hu Z, Zhang H, et al. A Through-Intact-Skull (TIS) chronic window technique for cortical structure and function observation in mice[J]. eLight, 2022, 2(1): 1-18. 3.WANG Jing,ZHANG Yang,XU Tonghui,et al. An innovative transparent cranial window based on skull optical clearing. Laser Physics Letters, 2012, 9(6): 469-473. 4.ZHAO Yanjie,YU Tingting,ZHANG Chao,et al. Skull optical clearing window for in vivo imaging of the mouse cortex at synaptic resolution. Light-Science & Applications,2018,7(2):17153. 5.ZHANG Chao,FENG Wwei,ZHAO Yanjie,et al. A large, switchable optical clearing skull window for cerebrovascular imaging. Theranostics,2018,8(10):2696-2708. 6.CHEN Yage,LIU Shaojun,LIU Hongjie,et al. Coherent Raman scattering unravelling mechanisms underlying skull optical clearing for through-skull brain imaging. Analytical Chemistry,2019,91(15):9371-9375. 7.LI Dongyu,ZHENG Zheng,YU Tingting,et al. Visible-near infrared- Ⅱ skull optical clearing window for in vivo cortical vasculature imaging and targeted manipulation. Journal of Biophotonics,2020,13(10):e202000142. 8.李东宇,俞婷婷,朱京谭,朱?.活体颅骨光透明方法及应用(特邀)[J].光子学报,2022,51(08):252-268.
文案 | 灵犀 排版 | 周琦 李海月 审核 | Jane 刘泽鹏
|